La investigación de los científicos del CONICET en el Instituto Leloir se realizó en moscas Drosophila melanogaster, un modelo de investigación que sirve para iluminar procesos en humanos. La disfunción del reloj biológico se asocia al desarrollo de ciertos tipos de cáncer, enfermedades cardíacas, diabetes tipo 2, infecciones y obesidad.
(Agencia CyTA-Leloir)-. La llamada “remodelación circadiana”, una modificación diaria en las conexiones neuronales del reloj biológico que influye en la regulación del sueño y la vigilia, entre otras funciones, parece ser el resultado de la interacción de diversas neuronas y no sólo de algunas específicas, como se pensaba. Así lo revela un nuevo trabajo de científicos de la Fundación Instituto Leloir (FIL) liderados por Fernanda Ceriani, jefa del Laboratorio de Genética del Comportamiento.
El estudio ilumina mecanismos que regulan la comunicación de diferentes grupos de neuronas del reloj biológico y podría favorecer en el futuro el diseño de estrategias para abordar su disfunción.
Hace más de una década se propuso que cada grupo de neuronas del reloj biológico (cuya disfunción se asocia a complicaciones de la salud) cumplía un papel acotado y específico para lograr la organización temporal de la actividad diaria: el sueño, la vigilia y otros procesos. Ahora, el trabajo encabezado por Ceriani arroja nueva evidencia que cuestiona esa idea.
En 2008, el laboratorio de Ceriani realizó experimentos enfocados en la red circadiana de la mosca Drosophila y descubrió que uno de los grupos funcionales de neuronas del reloj biológico, las llamadas “neuronas ventrales laterales pequeñas” (sLNvs, según sus siglas en inglés) o “M”, remodela sus conexiones o sinapsis a diario. Ahora descubrieron que lo mismo ocurre con otro tipo de neuronas reloj: las dorsales laterales (LNds, según sus siglas en inglés) o “E”.
“Lo que mostramos es que la remodelación circadiana no está limitada a un sólo grupo de neuronas reloj, sino que parece ser una propiedad más general que modula la comunicación entre grupos de relojes”, indicó Ceriani, también investigadora del CONICET y ganadora del Premio Nacional L’Oréal-Unesco Por la Mujer en la Ciencia 2011.
“De este modo, impacta en los procesos regulados por el reloj circadiano, como los ciclos de sueño y vigilia”, añadió Ceriani.
Neuronas reloj
La red circadiana o reloj biológico de la mosca Drosophila está compuesta de 150 neuronas organizadas en grupos ¨funcionales¨ que de manera sincronizada se encargan de regular una amplia gama de procesos metabólicos, fisiológicos y comportamentales para que ocurran en los momentos más adecuados del día.
“Mucho de lo que hoy se sabe de cómo opera el reloj biológico en mamíferos proviene de experimentos en Drosophila”, destaca Ceriani. Y agrega que este modelo “ofrece innumerables ventajas, no sólo por la cantidad de herramientas y el conocimiento disponible, sino que, por su simpleza, facilita descubrir la lógica con la que opera la red neuronal circadiana”.
Tal como revela la revista “Current Biology”, Ceriani y equipo descubrieron que las sinapsis de las neuronas E del reloj biológico se arman y desmantelan a lo largo del día. “Lo que es aún más interesante es que le pudimos asignar una función a esa remodelación, y es que permite liberar a lo largo del día un neurotransmisor llamado acetilcolina (también presente en humanos) que favorece la comunicación entre las neuronas”, explicó la científica.
Los investigadores también iluminaron detalles del “diálogo” entre dos grupos funcionales de neuronas reloj: las células E (que controlan el pico actividad de la tarde) y las células M (que controlan el pico de actividad de la mañana), incluyendo la retroalimentación de unas y otras en momentos específicos del día. “Es una cinta sin fin, como la sucesión de días y noches”, expresó Ceriani.
En las últimas décadas, se han publicado cientos de trabajos que apuntan al impacto sobre la salud de tener un reloj alineado con los ciclos naturales. De hecho, tanto en animales de laboratorio como en humanos se ha mostrado que la disrupción crónica de los ritmos endógenos se asocia a una mayor susceptibilidad a ciertos tipos de enfermedades, desde obesidad y diabetes hasta cáncer y depresión estacional.
“Desentrañar cómo funciona la red circadiana y cómo regula toda nuestra fisiología es esencial para luego ver de qué manera se puede limitar la desincronización, así como para diseñar en el futuro tratamientos para trastornos asociados con la disfunción de reloj biológico”, concluyó Ceriani, quien ha participado en trabajos científicos con Michael Rosbash, uno de los ganadores del premio Nobel de Medicina de 2017.
Del avance también participaron el primer autor del trabajo, José Manuel Duhart, de la FIL y del CONICET, actualmente en una estancia posdoctoral con una beca Pew en el Instituto Farber de Neurociencias de la Universidad Thomas Jefferson, en Filadelfia, en Estados Unidos; Anastasia Herrero, de la FIL y del CONICET, realizando ahora una estancia postdoctoral en el Instituto de Investigación Biomédica (IRB), en Barcelona, España; Gabriel de la Cruz y Juan Ignacio Ispizua, del CONICET y de la FIL; y Nicolás Pírez, del CONICET, de la FIL y de la Facultad de Ciencias Exactas y Naturales de la UBA.

Los autores del estudio: Fernanda Ceriani (arriba izq.), José Manuel Duhart, Nicolás Pírez, Juan Ignacio Ispizua, Anastasia Herrero y Gabriel de la Cruz.
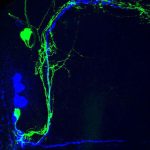
Los científicos descubrieron que las neuronas E (verde) del reloj biológico remodelan sus conexiones o sinapsis a diario, y mantienen una comunicación de retroalimentación con las neuronas reloj M (azul).


